16.5 Bradyarytmie
Milan Chovanec
Optimální prokrvení tělesných orgánů je zajištěné funkčním a vysoce efektivním přečerpáváním krve, což je umožněno správnou prací srdce. Srdce pracuje jako tlakově-objemová pumpa a je složeno z čtyř částí: 2 komory (pravá, levá) a 2 předsíně (pravá, levá). Pumpování krve srdečními komorami je zajištěno pořád se opakujícími cykly, tzn. plnění (diastola) a vypuzení (systola). Tyto srdeční cykly jsou ovlivněny srdeční frekvencí, tj. počtem srdečních stahů (úderů) za minutu. Každý člověk si může měřit svoji srdeční frekvenci nejčastěji pohmatem tepen na zápěstí, na krku nebo v třísle, lze využít i tonometru (přístroje na měření krevního tlaku) při běžném měření krevního tlaku, přístroj současně ukazuje i pulzy. Cyklická elektrická aktivita srdečních buněk tzv. převodního aparátu vzniká přímo v srdci tak, aby bylo zajištěno pravidelné a efektivní vypuzování krve (systola), ale také aby si srdce mohlo „odpočinout“ v době, kdy se komory plní krví (diastola). Jde o autonomní (srdci vlastní) funkci, kterou nazýváme přirozeným pacemakerem. Tato elektrická aktivita vychází z přirozené schopnosti určitých buněk se samostatně elektricky aktivovat a pak dále předávat tuto elektrickou informaci dalším srdečním buňkám. Jde o relativně nezávislou pacemakerovou aktivitu, která není přímo ovlivněná periferní ani centrální nervovou aktivací. Srdce je sice zásobeno speciálními nervovými buňkami, které jsou součástí vegetativního nebo „autonomního“ nervového systému, ale aktivita těchto nervových buněk ovlivňuje pouze zrychlení, event. zpomalení srdeční frekvence nebo ovlivňuje elektrickou dráždivost srdečních buněk, a tím nepřímo nebo přímo ovlivňuje i potenciál pro vznik některých srdečních arytmií. Praktickým příkladem významu spontánní, autonomní srdeční aktivity jsou pacienti po transplantaci srdce. Transplantované srdce od dárce se vloží do hrudníku pacienta příjemce, napojí se cévy srdce na cévy těla příjemce, ale napojení nervů mezi srdcem od dárce a tělem příjemce není prakticky ani technicky možné. Nicméně pacient po transplantaci přežije často i několik desetiletí, a to pouze na základě spontánní, autonomní aktivity samotného transplantovaného srdce.
Cyklická autonomní aktivita je specifická pro srdce, podobný mechanismus se nenachází v žádné jiné tkáni těla a vzniká v specializovaných buňkách uložených v srdci. Přibližně 99 % všech buněk v srdci se zařazuje do skupiny pracovního myokardu, tzn. buněk přímo se podílejících na přečerpávání krve, kdy se cyklicky stahují srdeční síně a následně dochází ke stahu srdečních komor. Tím, že se nejdříve stahují síně a následně pak komory, dochází k dokonale efektivnímu přečerpání, tedy zajištění optimálního srdečního výdeje (kalkuluje se v litrech za minutu a v klidu je 4–8 l/min). Zhruba 1 % srdečních buněk nazýváme buňkami převodního aparátu srdce, a ty se přímo nepodílí na mechanické funkci srdce krve. Zajišťují nepřetržitou a cyklickou (pravidelně se opakující) aktivaci a synchronizaci buněk pracovního myokardu. Jejich funkce je zajištěna specifickou strukturou buněčné membrány (obal oddělující buňku od okolí), která se nenachází v žádném jiném typu buněk v těle. Tyto buňky se shlukují v různých specifických částech srdce a vytvářejí uzly a dráhy, které způsobují cyklickou aktivaci (uzly) a zároveň zajišťují synchronizaci (dráhy) aktivace pracovního myokardu, podílí se na co nejefektivnějším pumpování krve srdcem. Tyto buňky převodního aparátu byly poprvé popsány naším fyziologem Janem Evangelistou Purkyně a také se po něm nazývají jako „Purkyňovy buňky“ nebo „Purkyňova vlákna“. Jde prakticky o modifikované a vývojem pozměněné svalové buňky srdce – myocyty, které se specializovaly na tvorbu nebo vedení elektrického impulzu, což je velmi složitý proces, který přesahuje rámec tohoto textu. Za patologických okolností (nedokrvení – ischemie, patologický proces struktury srdeční tkáně – kardiomyopatie, vazivová přestavba – fibróza, zánět srdečního svalu – myokarditida, systémová infekce, otrava, úraz apod.) dochází k poškození buněk převodního systému, a tím dochází ke zpomalení až vymizení spontánní autonomní aktivity srdce – porucha uzlů – nebo dochází k poškození synchronizace aktivace pracovního myokardu – porucha specifických drah.
Za normální srdeční frekvenci v klidu se považují hodnoty v rozmezí 60–100 úderů za minutu. V některých speciálních situacích (např. výkonnostní sportovci apod.) je klidová srdeční frekvence nižší než 60 úderů za minutu a lze ji tedy u těchto trénovaných jedinců považovat za normální. Pokud buňky v organismu potřebují zvýšené množství kyslíku (např. fyzická aktivita, trávení, psychické vypětí apod.), je zdravé srdce schopno zvýšit množství pumpované krve do těla zrychlením přečerpávání krve – tj. urychlením srdeční frekvence (počet srdečních cyklů přes 100 za minutu). Jde o stav, který odborně nazývámetachykardie. Pokud jsou buňky převodního systému poškozeny, viz popis výše, dochází ke zpomalení spontánní autonomní aktivity – srdeční frekvence v klidu je nižší než 60 úderů za minutu a srdce není schopné zrychlit srdeční aktivitu dle potřeby. V tomto případě jde o stav, který nazýváme bradykardie. V některých případech sice klidová frekvence neklesá pod 60 za minutu, ale frekvenci není možné zvýšit dle potřeby. Tento stav nazýváme chronotropní inkompetencí, tedy nemožností reagovat zrychlením srdeční frekvence na metabolické potřeby organismu vzniklé nejčastěji v souvislosti se zvýšenou pracovní – fyzickou zátěží.
Pomalá srdeční frekvence, bradykardie, způsobí snížené množství přečerpávané krve v důsledku výrazně zpomalené srdeční aktivity, a tím se sníží i průtok krve mozkem, svaly a všemi ostatními orgány v těle. Dochází k tzv. hypoperfuziorgánů (snížení prokrvení) a dle významu jednotlivých orgánů také k postižení jejich funkce. Projeví se to klinicky hlavně jako: celková únava, nevýkonnost, dušnost, motání hlavy. Při významném zpomalení nebo vynechání elektrické aktivace srdce dochází ke kolapsu nebo pak až ke ztrátě vědomí na přechodnou dobu, může trvat několik vteřin nebo až desítek vteřin – projevuje se jako synkopa(viz kapitola 18). Jakákoli porucha převodního systému může být velmi významná a životu nebezpečná. Z praktického pohledu jsou nejhorší dočasné/přechodné poruchy převodního sytému, které se vyskytují nejčastěji nepředvídatelně a mohou způsobit velmi závažné poškození nejenom samotného pacienta (pády, úrazy, smrt apod.), ale i jeho okolí (autonehoda, jiné neštěstí…).
V současné době onemocnění nebo poškození převodního systému srdce, která vedou k výraznému zpomalení srdeční frekvence nebo k zastavení srdce (asystolie), není možné vyléčit. Nelze ani spoléhat na dlouhodobou farmakoterapii. Při selhání vlastního převodního systému srdce je možné pouze nahradit jeho funkci umělým systémem elektrické aktivace, kterou nazývámekardiostimulace, tedy náhradním pacemakerem. Transvenózní trvalá kardiostimulace se prakticky v minimálně pozměněné podobě provádí od roku 1958, kdy byl ve Švédsku zaveden první implantabilní kardiostimulátor. Skládá ze dvou hlavních částí: kardiostimulační přístroj a izolovaný vodič stimulační elektrody.Arteficiální pacemaker je kovová „krabička“ velikosti přibližně 50 × 40 × 5 mm, která umožňuje registrovat vlastní srdeční aktivitu a následně dle potřeby vysílat elektrické impulzy o nízké energii k aktivaci srdce. Kardiostimulační přístroj obsahuje dnes dominantně používané lithiové baterie, řídící čip a elektronický systém komunikace s programerem, tedy přístrojem sloužícím k neinvazivnímu nastavení režimu stimulace. Současné kardiostimulační systémy obsahují řadu programovatelných parametrů a slouží i jako ideální monitory srdeční frekvence a výskytu různých arytmií. Všechny uvedené komponenty jsou hermeticky uzavřeny v titanovém pouzdře tak, aby se zamezil vstup tělesných tekutin a všechny součásti kardiostimulačního přístroje tak nepodléhaly korozi.Srdeční elektroda/elektrody, jsou speciální spirálou vinuté kovové drátěné vodiče (průměr 2–3 mm), jako izolační materiál se dnes používá ponejvíce silikon. Zavádějí se do srdečních dutin (nejčastěji pravé srdeční komory a síně, zakotvené do srdeční stěny buď aktivní šroubovicí, nebo pasivní fixací, a ty jsou pak propojené s kardiostimulátorem na straně druhé. Stimulační elektrody se fixují svými konektory do kontaktních částí kardiostimulátoru a zajišťují propojení srdce a pacemakeru navzájem. V současné době používané kardiostimulační systémy (přístroj + elektroda/y) umožňují, na podkladě snímané srdeční aktivity, okamžitou analýzu srdeční činnosti čipem kardiostimulátoru a pak, dle potřeby, vyslání elektrického stimulačního impulzu z kardiostimulátoru do srdce. Jak jsme uvedli výše, obsahují řadu programovatelných funkcí, která zlepšuje jejich výkonost, šetří bateriové zdroje a také umožňuje dlouhodobé monitorování nemocného nejenom ve smyslu srdeční frekvence, ale také například i odporu tkání, a tak je možné sledovat i průběh nemocných se srdečním selháním.
Výkon implantace kardiostimulačního systému se provádí při vědomí v místním znecitlivění. Kardiostimulátor se vkládá do podkožní kapsy (vytvoří se malý prostor mezí kůží a svalem) v podklíčkové oblasti nejčastěji vlevo, méně často vpravo. Elektroda/elektrody se zavádějí přes žílu pod klíční kostí do srdce, nejčastěji do pravé srdeční komory a pravé srdeční síně. Jak je uvedeno výše, fixují se do tkáně pracovního myokardu speciálním mechanismem – mikrošroubovicí nebo pasivně s využitím silikonových kotev, které se zachytí pasivně do srdeční svalové trámčiny. Celý výkon se provádí na specializovaném operačním sále pod kontrolou rentgenového přístroje a časově dohromady s přípravou a odstrojením po výkonu trvá přibližně 30–40 minut. Pacient připravovaný k implantaci plánovaně by měl být nalačno. V případě, že nemocný dlouhodobě užívá antikoagulační léčbu, není v souvislosti s výkonem potřeba ji vysazovat, lze pouze upravit dávkovací schéma. Je prokázáno, že úpravou dávkování nedochází k zvýšení počtu krvácivých komplikací. V případě Warfarinu a hodnocení indexu INR je dostačující pouze snížení dávky tak, aby hodnota INR byla v rozmezí 2–3 INR. U nově používaných antikoagulačních preparátů (Pradaxa, Xarelto, Eliquis, Lixiana) není nutné je vysazovat vůbec. Po provedeném výkonu je nemocný minimálně cca 1–2 hodiny v klidu na lůžku, pak jej sledujeme v nemocnici přes noc do druhého dne. Pokud vše probíhá bez komplikací, nemocný druhý den po výkonu opouští nemocnici. Všichni pacienti jsou vybaveni průkazkou s uvedenými daty svého kardiostimulátoru, upozorněním, jak se chovat v běžných denních situacích (souvisí s tím i kontroly na letištích). Nemocní s kardiostimulátorem jsou pravidelně sledováni kardiologem, který má licenci ke sledování nemocných s pacemakerem a je vybaven příslušnými programery.
Každý invazivní výkon je zatížen rizikem komplikací, které jsou ale v případě trvalé kardiostimulace poměrně vzácné. Nejčastější komplikací je krvácení v kapse přístroje v podklíčkové oblasti, což vyžaduje opětovné otevření kapsy, vyčištění a ošetření tkáně. Při zavádění elektrod přes žílu v podklíčku se může stát, že pronikne vzduch mezi plíci a hrudní stěnu (pneumothorax) a plíce splaskne a nedýchá. Přebytečný vzduch při pneumothoraxu se řeší zavedením hadičky přes hrudní stěnu a jeho odsátím, což prodlouží pobyt v nemocnici většinou o 4–5 dní. Velké krvácení (hemothorax) je výjimečná komplikace a velmi často vyžaduje chirurgickou operaci v celkové anestezii. Méně časté komplikace jsou způsobeny vypadnutím (dislokací) elektrod z místa uložení v srdci nebo propíchnutím (perforace) srdeční dutiny elektrodou. Další vzácné komplikace jsou poškození nebo zlomení elektrod, infekce. Čím později od implantace vzácná komplikace vznikne, tím je řešení komplikovanější a je vázáno na několik specializovaných pracovišť, mezi které patří i Nemocnice Na Homolce.
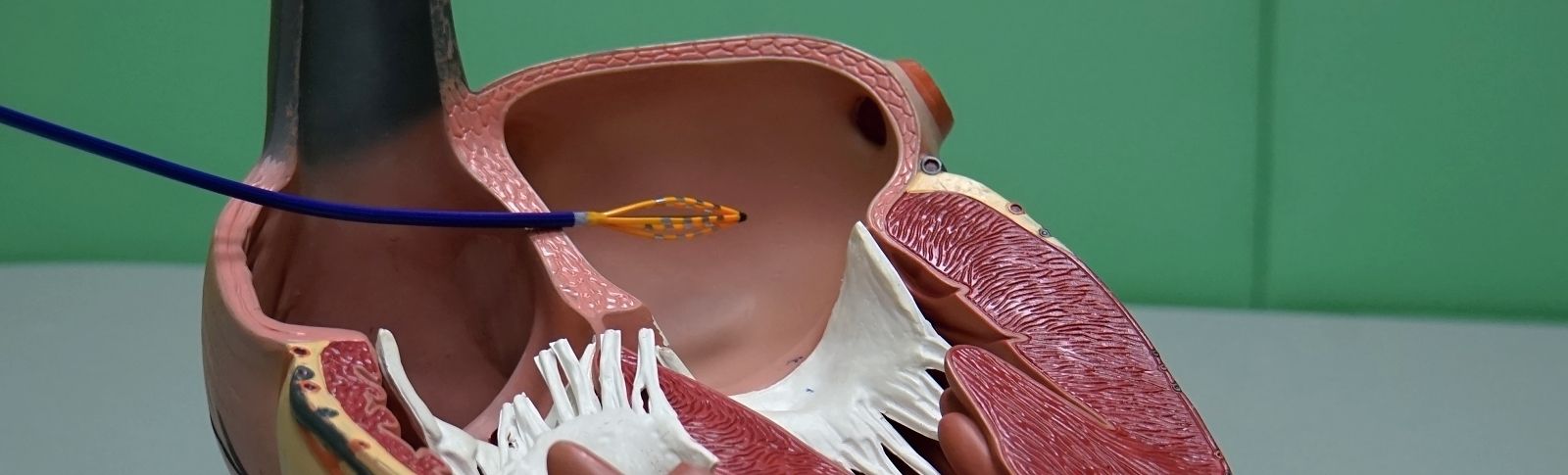
V současné době, a to od roku 2012 se používá i nový způsob stimulace srdce systémem bez použití stimulačních elektrod. Jde o nový typ stimulačního systému bez použití vodičů elektrod, který nazýváme leadless – tedy česky bezdrátovou, bezvodičovou kardiostimulací. Tento stimulační systém je tvořen přístrojem tvaru válečku cca 50 × 5 mm, který se zavádí zatím pouze do jedné dutiny, a to do pravé komory přes stehenní žílu pomocí speciálního zavaděče a zaváděcího katétru většinou z pravého třísla. Po proměření všech elektrických parametrů a testu stability úponu stimulační kapsle se zaváděcí katétr uvolňuje, a nakonec v srdci zůstává pouze samotný přístroj. Tento systém eliminuje drtivou většinu komplikací spojených s trvalou kardiostimulací, viz výše. Leadless stimulace je zatím vhodná pouze pro omezený typ pacientů (stimulace pouze pravé srdeční komory), nicméně očekáváme, že v blízké budoucnosti dojde významnému rozšíření možností včetně dvoudutinové stimulace (stimulace pravé síně a pravé komory). V použití těchto typů výkonů patří Nemocnice Na Homolce k světovým průkopníkům.