6.2 Ischemická choroba srdeční
Petr Volf
Ischemická choroba srdeční (ICHS, nyní nověji označována jako chronické koronární syndromy) je proces, při kterém dochází k nedostatečnému okysličení srdečního svalu (myokardu) vzhledem k poptávce. Nejčastější bývá postižení cév zásobujících srdeční sval (tzv. věnčité, koronární tepny) aterosklerózou, což je „ukládání cholesterolu“ do stěn těchto tepen. To způsobí zúžení lumen cévy a při zátěži, kdy je zapotřebí zvýšeného průtoku tepnou, nedostatečné zásobu kyslíku. To může způsobovat postupné zhoršování funkce srdečního svalu, a hlavně levé komory jako pumpy.
Pacienti vnímají toto postižení jako pálení na hrudi při námaze různé intenzity a při různé námaze (angina pectoris). Záleží na míře zúžení. Bolest se také může propagovat do levé horní končetiny, krku, dolní čelisti, břicha nebo i mezi lopatky. U diabetiků bolesti na hrudi nemusejí být vůbec vyvinuty a obtíže se projevují jako námahová dušnost (tzv. ekvivalent anginy pectoris). V případě, že nedochází k žádným obtížím, mluvíme o němé ischemii. Pokud již došlo v postižení srdečního svalu jako pumpy, mohou přibýt i otoky nohou, únava, nevýkonnost, břišní dyskomfort aj. Mezi rizikové faktory patří věk, pohlaví, rodinná zátěž, kouření, abdominální obezita, cukrovka, vysoký krevní tlak, dyslipidemie, nedostatek pohybu, stres a další.
Diagnostika se opírá o elektrokardiograf (EKG, elektrická aktivita srdečního svalu), laboratorní odběry (markery srdečního selhání, odumírání buněk srdečního svalu aj.), echokardiografii (ECHO, poruchy pohyblivosti srdce, funkce levé komory a další), zátěžové vyšetření (ergometrie, zátěžový SPECT myokardu, perfuzní magnetickou rezonanci, zde můžeme zjistit poruchu prokrvení srdečního svalu, jizvu). Mezi invazivní vyšetření patří selektivní koronarografie (SKG), což je vyšetření, při kterém se nejčastěji z pravého zápěstí (lze i z levého nebo z pravého třísla) zavedou přes tepny tzv. katétry k odstupu věnčitých tepen a aplikuje se do nich rentgen-kontrastní látka za společného provedení krátkého rentgenového videa. To se provádí v několika projekcích, aby se zobrazily všechny úseky věnčitých tepen. Na konci tohoto vyšetření můžeme určit, zdali je přítomno nějaké zúžení věnčité tepny, eventuálně v jakém místě, jak je významné atd. Léze se mohou dělit na nevýznamné a významné. Nejsložitější je hodnocení hraničně významných lézí, u kterých nelze jednoznačně rozhodnout, jaký klinický význam mají. K tomu lze použít doplňující modality, jako je funkční průtoková rezerva (FFR – fractional flow resere). Měří se tlak před stenózou a za ní pomocí senzoru. Další možností je použití intravaskulárního ultrazvuku (IVUS – intravascular ultrasound) nebo optické koherenční tomografie (OCT – optical coherence tomography), díky níž můžeme změřit přímo plochu dané tepny.
Léčba je možná nefarmakologická (ovlivnění ovlivnitelných rizikových faktorů – kouření, obezita…), dále farmakologická (léky na snížení cholesterolu v krvi, na snížení tlaku krve, kompenzaci cukrovky apod.).
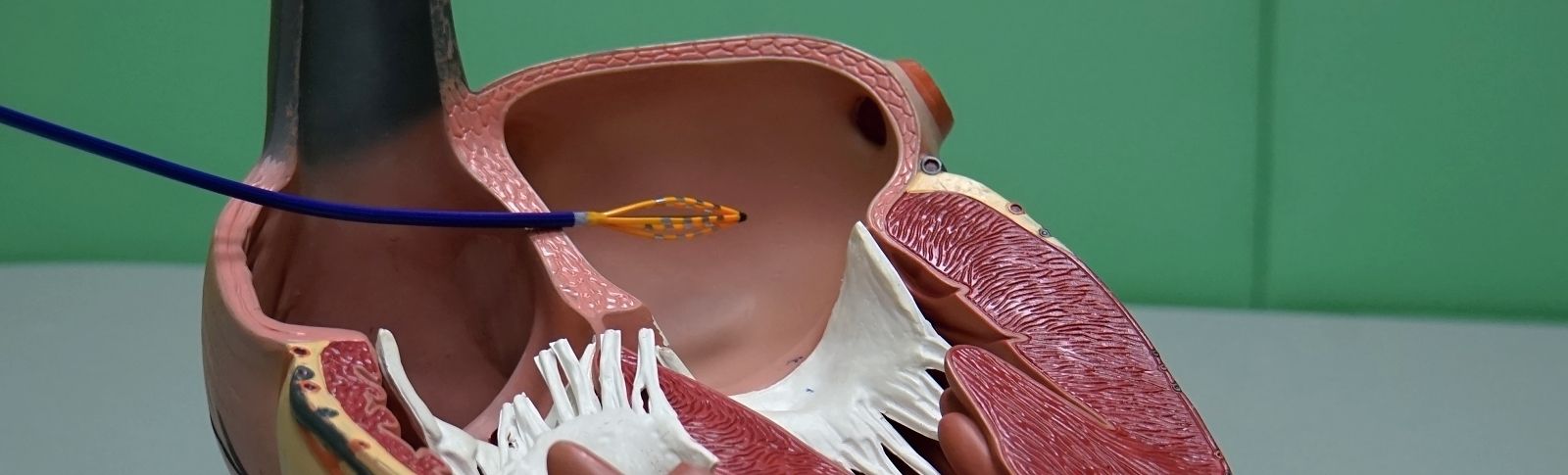
Mezi invazivní metody patří perkutánní koronární intervence (PCI). Při této metodě se opět nejčastěji přes radiální tepnu (může se provádět v přímé návaznosti na selektivní koronarografii) zavedou podobné katétry, v tomto případě s větším průměrem. Těmi se opět nasonduje odstup věnčité tepny. Poté se přes zúžené místo zavede tzv. vodič – tenký drátek. Je několik typů vodičů – rozdělují se dle tvrdosti koncové části, odolnosti k deformaci, typu zakončení (strunka vs. hydrofilní konec). Pokud se podaří přes postižení proniknout, zavede se do zúženého místa po tomto vodiči balonek, který se poté nafoukne – predilatace. Tím se rozruší struktura plátu a kalcifikací. Balonky mají různou délku a různý průměr udávaný v milimetrech. Jsou buď kompliantní, semikompliantní nebo nonkompliantní – dáno tím, o kolik zvětší svůj průměr v závislosti na tlaku. Následně se použitý balon vytáhne a po vodiči se zavede stent (jakási výztuž ve tvaru trubičky), roztáhne se pomocí malého balonku a vyztuží zúžené místo. V případě, že nedošlo k úplnému roztažení stentu a hrozil by vznik trombu (krevní sraženiny), provede se tzv. postdilatace – slouží k doroztažení stentu – používají se převážně nonkompliantní balonky. K ověření roztažení stentu lze také použít metodu OCT.
Pokud nelze provést ošetření tepen touto metodou, je možné pomocí kardiochirurgické operace našít tzv. bypassy, přemostění postiženého pomocí tepenných a žilní štěpů. Tato metoda je poté již v kompetenci kardiochirurgů.
Míšní stimulace
Ischemická choroba srdeční je postižení tepen, které zásobují srdeční sval krví. V důsledku rozvoje aterosklerotického postižení dochází k jejich zúžení a tím nedostatečnému zásobení buněk srdečního svalu kyslíkem. To se projevuje jako tlaková, pálivá bolest na hrudi při námaze různé intenzity (angina pectoris), podle její intenzity se ischemická choroba srdeční klasifikuje ve čtyřech stupních.
Léčbou první volby je katetrizační, tedy punkční technikou prováděné rozšíření zúženého místa, tzv. perkutánní koronární intervence. Další možností je našití bypassů (tepenné nebo žilní přemostění zúženého místa) během kardiochirurgického výkonu. Nedílnou součástí léčby anginy pectoris, tedy přesněji ischemické choroby srdeční (ICHS), jsou režimová opatření a farmakologická léčba v rámci sekundární prevence ICHS. Bohužel ne vždy je možné koronární intervenci nebo našití bypassů provést (věk, přidružená onemocnění, neřešitelný nález na věnčitých tepnách apod.). Tito pacienti mají pro neřešitelné anginózní obtíže výrazně sníženou kvalitu života. Nemocní s takto vysokým stupněm anginy pectoris refrakterní na maximalizovanou medikamentózní léčbu, kteří tedy zároveň nejsou vhodnými kandidáty k provedení revaskularizačního zákroku, mají pak z terapeutického hlediska minimální možnosti zásadnějšího zlepšení při použití standardních postupů. Těmto pacientům nabízí naše pracoviště symptomatologickou léčbu anginy pectoris v podobě implantace míšního neurostimulátoru nebo moderněji neuromodulátoru.
Míšní stimulaci (SCS – spinal cord stimulation) jako způsob léčby refrakterní anginy pectoris poprvé použili Murphy a Giles v roce 1987, když navázali na výsledky práce Mannheimera z počátku osmdesátých let, který použil k redukci epizod anginy pectoris transkutánní nervovou stimulaci (transcutaneous electrical nerve stimulation – TENS). Základní námitky, že trvalá stimulace míchy vede k maskování příznaků akutního infarktu myokardu, vede k instabilizaci anginy pectoris, nebo že dokonce může zvyšovat výskyt srdečních arytmií, nebyly prokázány. Základní princip mechanismu účinku neurostimulace zatím není zcela jasně prokázán, uvažuje se o přímém ovlivnění bolesti stimulací nízkoprahových A vláken, která zprostředkovávají přenos nebolestivých podnětů. Jejich stimulace (použitím SCS) tlumí senzitivitu vysokoprahových tenkých C vláken, která spinotalamickou drahou přenášejí bolestivé podněty. Dochází tak k přeměně bolestivých stavů na vibrace a brnění v místě původní projekce bolesti, takže výsledkem SCS je zlepšení tolerance zátěže a zároveň snížení myokardiální ischemie, tedy zlepšení prokrvení svalové buňky srdce.
Výkon se provádí v lokální anestezii, pacient je mírně tlumený a leží v poloze na břiše. Vlastní implantace neurostimulátoru spočívá v zavedení osmipolární stimulační elektrody epidurálně, tedy podél míchy. Provádí se nápich prostoru mezi obratlovými těly Th4 a Th5 (tedy úroveň hrudní páteře) pod rentgenovou kontrolou. Aktivní část elektrody pak obvykle stimuluje oblasti někde mezi přechodem krční a hrudní páteře, v úrovni obratlů C7–Th1.
Po zavedení elektrody následuje testování efektu míšní stimulace s úpravou parametrů neurostimulace. Důležitý je kontakt nemocného při testování rozsahu parestezie při spuštěné neurostimulaci. On určuje, zda ložisko vnímaného příjemného pocitu vibrací (odborněji to nazýváme parestezií) je shodné s ložiskem vnímané bolesti při epizodách bolesti na hrudi, tedy oněm atakám anginy pectoris. Je možné vybrat kombinace elektrod v různých etážích, kde je neurostimulace nejefektivnější. Pokud jsou parametry neurostimulace optimální, provádí se v jedné době implantace vlastního neurostimulátoru. Výkon trvá obvykle méně než 1 hodinu, po výkonu zůstává pacient v klidu na lůžku pouze 1–2 hodiny a druhý den odchází domů. Po propuštění z nemocnice probíhají pravidelné kontroly v šestiměsíčních intervalech v naší ambulanci, při nichž probíhá bezdrátová kontrola přístroje a eventuálně změna nastavení. Kapacita baterie vydrží 8–10 let dle režimu stimulace. Při výměně se pouze vymění vlastní přístroj, elektroda zůstává stejná. Tato výměna se provádí standardně v ambulantním režimu.
Neurostimulátor se programuje v několika automatických režimech buď jako nepřetržitá, nebo cyklická neurostimulace nezávislá na záchvatech anginózních obtíží a dále má nemocný vlastní aktivátor, kterým sám spouští stimulaci volným přiložením nad generátor. Pacientem aktivovaná stimulace by měla být spouštěna ještě před očekávaným nástupem AP nebo alespoň s jejím začátkem. Mezi potenciální komplikace léčby patří dislokace elektrody a infekce.
Naše pracoviště v podmínkách České republiky provádí tyto výkony jako unikátní centrum od roku 2000. Přestože jde o velmi individuální a přísně indikovanou léčbu, do tohoto roku jsme provedli již 40 implantací v léčbě refrakterní anginy pectoris. U těchto pacientů došlo ke zlepšení kvality života v podobě zvýšení tolerance námahy.
Je ale třeba míti na paměti, že se jedná pouze o symptomatologickou terapii ischemické choroby srdeční.
Data
- první implantace 25. 7. 2000
- k 30. 4. 2022 provedeno 40 implantací, 31 výměn
- průměrný věk implantace 65,49 let (47–85 let)
- sledování celkem 246,67 pacientoroků, nejdéle sledovaný 236 měsíců, průměr sledování 75,9 měsíců